ryu.です。
それでは今回は前回の続きから行きます。完全に塾講師みたいになってんなこれ(笑)。
化合物の決定法
有機化学においては題材となっている物質を問題文中にあるような方法で分析していき、どの化合物に当たるのかを考えていくのが主な流れなのだが、個人的にはこれは「推理ゲーム」のようなものと考えてほしい。自分の高校の担当教師がこう言っていたのを使わせてもらっているだけなのだが。ただ、推理をしようにもその判断材料をどう使っていくのかを知らなければお話にならないので、今回はそこの分析法にまずは焦点を当てていく。
今の科学ではこうした方法というよりは機械で分析するのがメジャーなのだが…。(教科書の発展欄などにIR、NMRといった単語が登場すると思うが、それだ)
組成式、分子式の判断
まずはここから。一番最初の段階と言っても過言ではない。その化合物に①どの元素がどの割合で含まれているのか、そして②分子量はどれほどかの、この二つについてまずは調べていく。まずは1番。
有機化合物の元素にはC、Hがメインとして含まれている。すると、まずはこの二つについて調べていくことが賢明であろう。ここでは有機化合物の燃焼によって二酸化炭素と水が生じることを利用していく。反応式は以下の通りだ。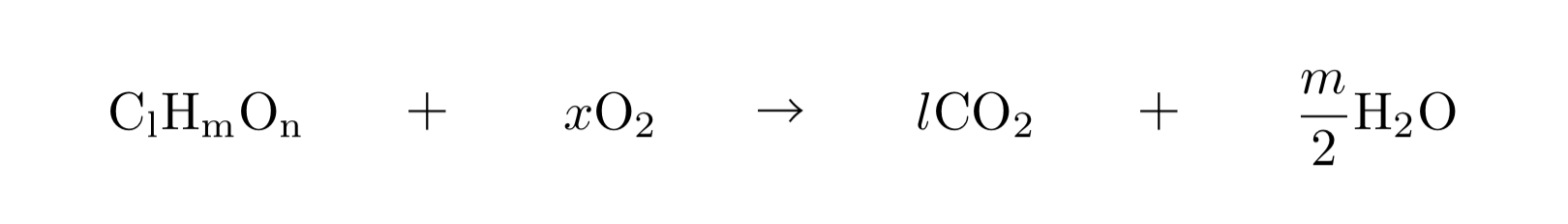
すると、反応によって生じたこの二つの物質の物質量は完全に対象の化合物中のC、H原子の物質量に依存するため(外からこれ以外の原子が関与しないから)、これによってこの二つの原子がどれくらい入っているかが分かる。実際に問題にする際にはこれ以外に酸素が入っている場合もあるが、実際に問題演習をやれば分かる通りこれについてもしっかりと分析可能である。一度ここで例題を挟んでみよう。
炭素C、水素H、酸素Oからなる化合物23mgを完全燃焼させると、二酸化炭素44mgと水27mgが得られた。この化合物の組成式を求めよ。
上に書いてある反応式を見ていくと、物質量の比や問題文中に出てくる量から推定することができる。順に見ていこう。
まず、燃焼と言っているから酸素の供給があるので、反応後の物質の量から酸素の物質量を推定することはできない(上の式参照)ので、残りを考えていく。生じる二酸化炭素の物質量と組成式中の炭素の物質量(l)、そして生じる水の物質量の2倍の値と組成式中の水素の物質量(m)がそれぞれ等しくなることから考えていく。水について注意だが、ここで2をかける必要があるのは水1分子に含まれる水素原子が2つであるからだ。すると、
$$ 炭素原子の物質量=\frac{二酸化炭素の質量(mg)}{二酸化炭素の分子量(g/mol)}=\frac{44}{44}=1.0mmol$$
$$ 水素原子の物質量=\frac{水の質量(mg)}{水の分子量(g/mol)}\times 2=\frac{27}{18}\times 2=3.0mmol$$
と求めていける。さらに残りは酸素の物質量を求めていくのだが、これは炭素と水素以外が酸素しかないので、
$$酸素原子の物質量=\frac{全体の質量-(炭素の質量+水素の質量)(mg)}{酸素原子の原子量(g/mol)}\\ =\frac{23-(1.0 \cdot 12+3.0 \cdot 1)}{16} = 0.50mmol$$
となる。以上より比を整数に整理して、\(C:H:O=2:6:1\)であるから、求める組成式は\(C_2 H_6 O\)である。
なお、この段階で分かるのはまだ原子の「割合」にすぎず、実際の分子量を合わせて考えることで化合物の分子式を特定していくのだ。なお、有機化合物にはそれ以外にも窒素や硫黄や塩素が入っている場合もあるのだが、これについては別の手段を用いる。啓林館の教科書にあった以下の表に纏まっているので見ておいて欲しい。センター試験においても出題例があったので要注意だ。実際の構造分析の問題においてこれらの手段が登場することは滅多にないが。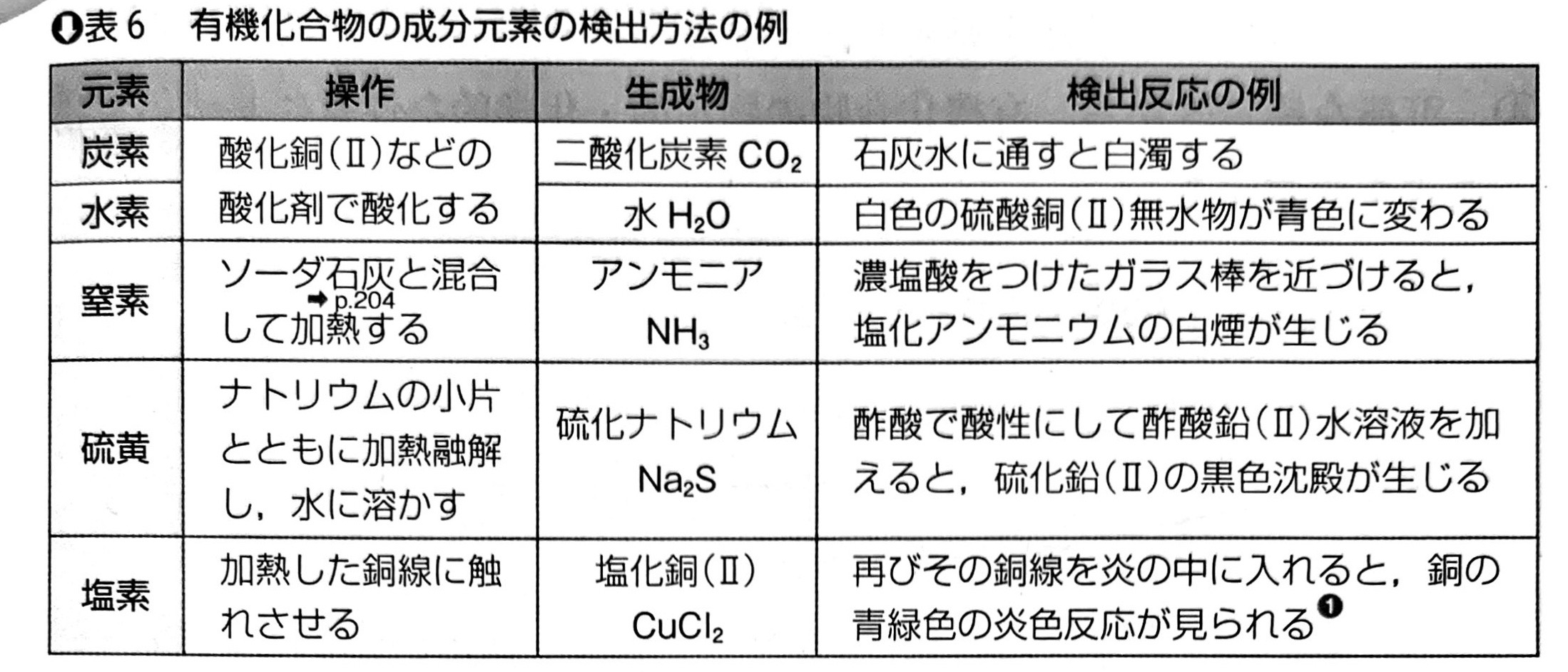
続いて②の段階である。ここではいくつか分子量を知るための手段を手短に紹介していくが、使うものは問題の条件によって判断していくのが合理的なので場合による。主な分析手段は気体の状態方程式や沸点上昇・凝固点降下、浸透圧などである。いずれも分子量が公式や関係式が絡んでいるものである。
異性体
さて、ここまでの操作で化合物の分子式まで求めることができたわけだが、有機化合物は同じ分子式でもその結合の組み合わせの違いによって様々な性質を持った化合物ができてしまう。そのためこれでは化合物の構造を特定したことにはならないのだ。そこで逆に、その化合物特有の物理的ないし化学的性質の違いに着目して細かい構造を決めていこうというのがここからの流れである。ちなみに、分子式では同じでも構造が異なっているものを異性体という。例えば\(C_3 H_8 O\)の異性体を考えてみてもこれだけの異性体が存在する。なお、前回紹介していなかったが、図に出てくる-O-の形はエーテル結合と言い、この形を含むものをエーテルという。この後で詳しく解説していく予定だ。
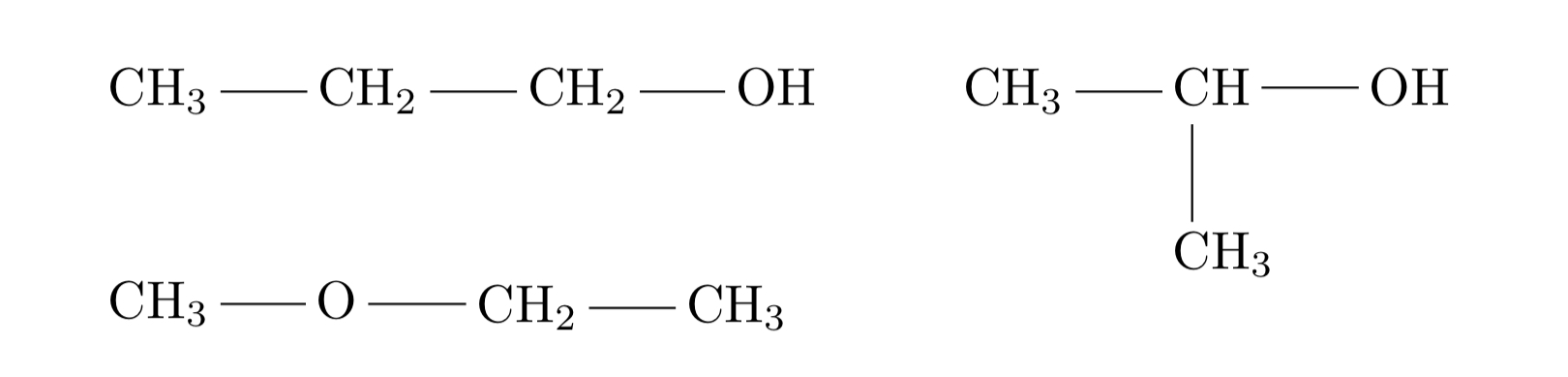
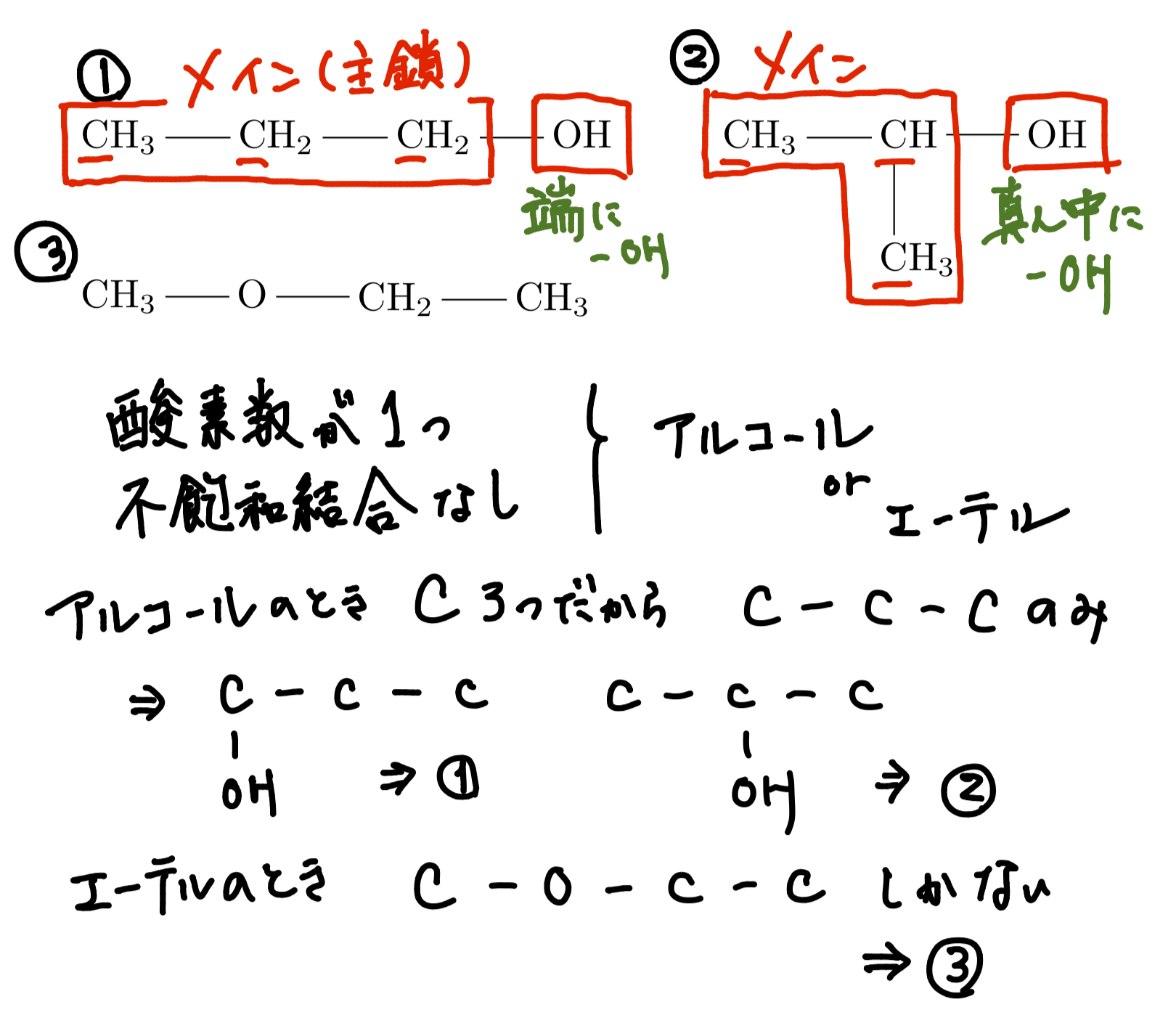 まず、炭素原子の繋がり方や不飽和結合の位置による違いから生じる異性体のことを構造異性体といい、上の3つは互いに全て構造異性体の関係にあるという。これを正確に書き出していくためにはそこそこの訓練が必要なので、各自の参考書や問題集等を利用して練習してみるのが良いだろう。基本的にまずは酸素原子数や不飽和度(どれほど二重結合や環状構造などの不飽和結合を持っているかの尺度)をベースに大まかな取りうる構造を決め、そして炭素の主鎖(メインとなる一番長く炭素が続いている部分)を決めていき、後からそれに残りのパーツをくっつけていくというのが自分のやっていたやり方。上の3つの分析の過程について右図に載せておくので、(汚い手書きで申し訳ないが)これを見てもらえると多少わかるかと。これに関しては人によってやり方なぞたくさんあると思うので、自分なりに演習の中で体系を組み立てていってほしい。後は違うように見えて被りだったというパターンも多いので、それについて気を付けられるようにするのも大事である。
まず、炭素原子の繋がり方や不飽和結合の位置による違いから生じる異性体のことを構造異性体といい、上の3つは互いに全て構造異性体の関係にあるという。これを正確に書き出していくためにはそこそこの訓練が必要なので、各自の参考書や問題集等を利用して練習してみるのが良いだろう。基本的にまずは酸素原子数や不飽和度(どれほど二重結合や環状構造などの不飽和結合を持っているかの尺度)をベースに大まかな取りうる構造を決め、そして炭素の主鎖(メインとなる一番長く炭素が続いている部分)を決めていき、後からそれに残りのパーツをくっつけていくというのが自分のやっていたやり方。上の3つの分析の過程について右図に載せておくので、(汚い手書きで申し訳ないが)これを見てもらえると多少わかるかと。これに関しては人によってやり方なぞたくさんあると思うので、自分なりに演習の中で体系を組み立てていってほしい。後は違うように見えて被りだったというパターンも多いので、それについて気を付けられるようにするのも大事である。
また、異性体にはもう少し厄介な種族が存在する。ここではそのうちシス−トランス異性体(幾何異性体)と鏡像異性体(光学異性体)について触れていこう。ジアステレオ異性体やメソ体なんかに関しては要望があれば別口で触れる。
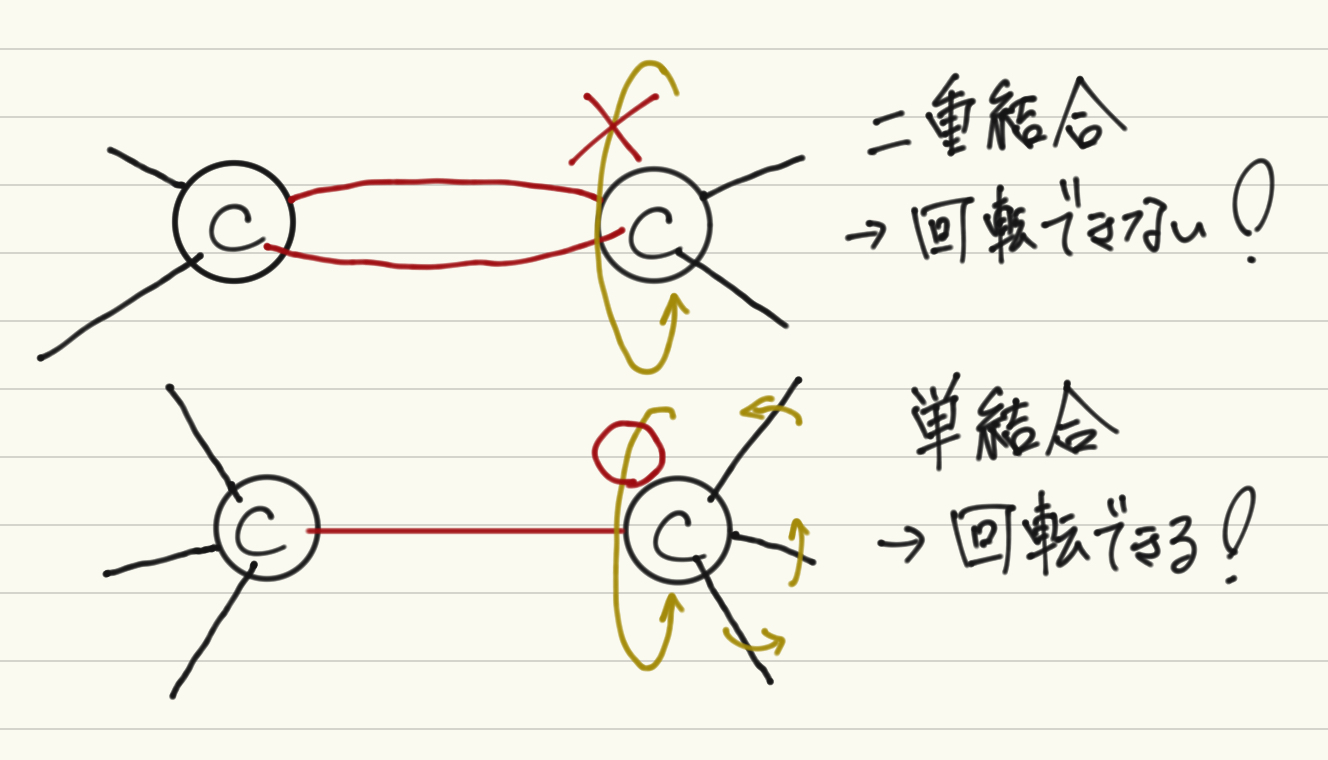 まずはシス−トランス異性体についてだが、その前に炭素間二重結合について話をしておこう。通常炭素間の単結合、すなわち腕1本同士での結合に関しては腕を軸にした回転が自由に効く。ところが、腕が2本以上になると途端に軸にした回転ができなくなってしまう。イメージからも想像は易いのでは。したがって、上の構造異性体を考える上で単結合においては意識しなくてよかった結合部分同士の位置関係について考える必要が出てくる。これがシス−トランス異性体が生じる理由だ。
まずはシス−トランス異性体についてだが、その前に炭素間二重結合について話をしておこう。通常炭素間の単結合、すなわち腕1本同士での結合に関しては腕を軸にした回転が自由に効く。ところが、腕が2本以上になると途端に軸にした回転ができなくなってしまう。イメージからも想像は易いのでは。したがって、上の構造異性体を考える上で単結合においては意識しなくてよかった結合部分同士の位置関係について考える必要が出てくる。これがシス−トランス異性体が生じる理由だ。
ちなみにもう少し込み入った話をすると(この趣旨のページで話す内容ではないが)、二重結合は実際には\(\sigma\)結合と\(\pi\)結合の二つの結合が存在しており、回転するためには\(\sigma\)結合と垂直にある結合性\(\pi\)軌道と半結合性\(\pi\)軌道同士が切り替わる必要があり、そのためには光を当てるなどして大きなエネルギーを化合物に照射する必要があるので通常の条件としてはここが切り替わることはないものとできる、というわけだ。
閑話休題。すると、二重結合している炭素原子について残りの二本の腕にそれぞれ別の基が結合しているとしよう。ここでは簡単のために2-ブテン(\(C_4H_8\))を考える。そうすると、以下の図のように構造異性体を描く上では同じように思えても結合の仕方が変化して異性体となりうるのである。なお、二つの基が二重結合を軸として同じ方にあるものをシス異性体、異なる方にあるものをトランス異性体という。

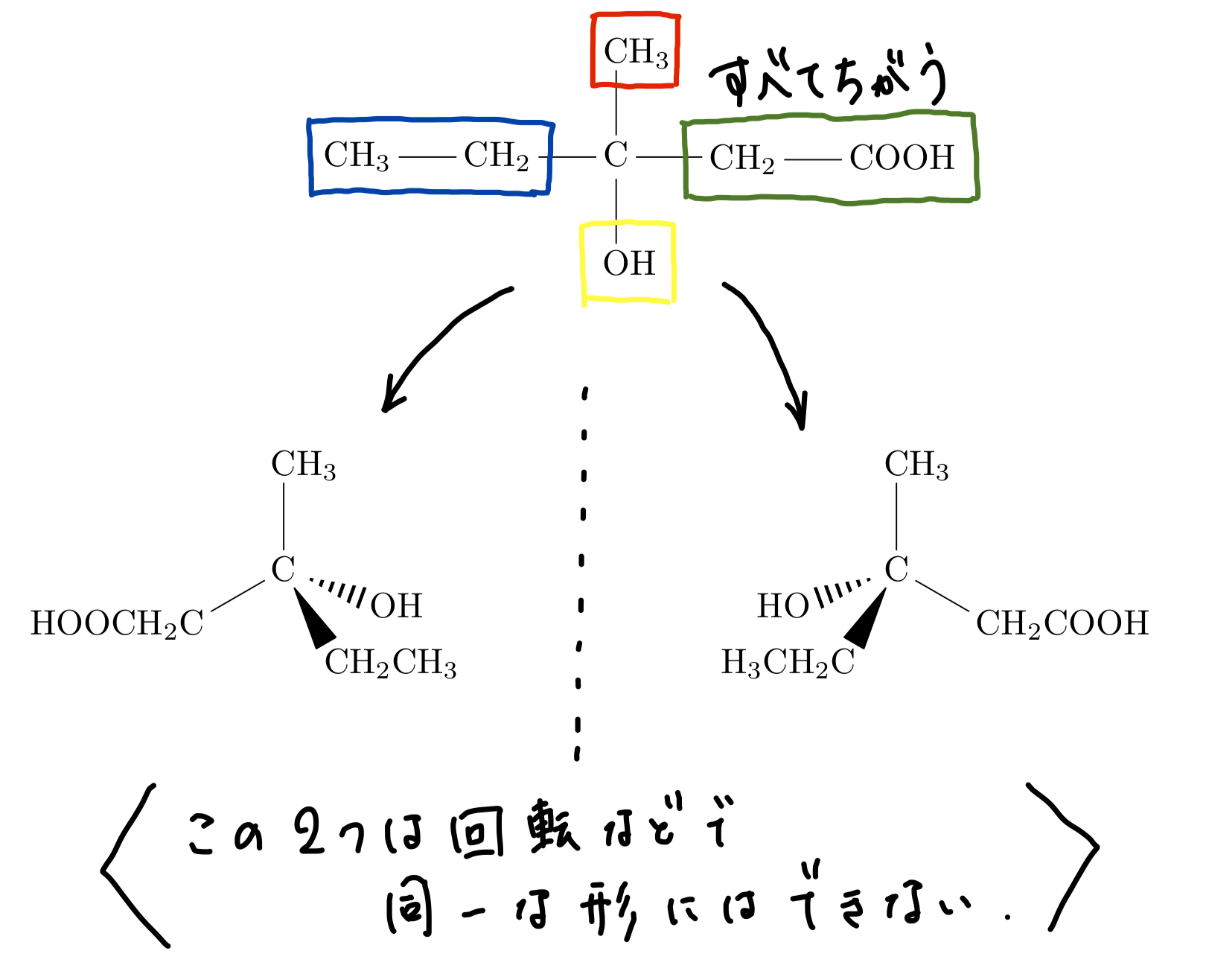 続いては鏡像異性体。こちらも先に不斉炭素原子というものを紹介しておく。化合物の分子内のある炭素原子に対して、その価標に伸びている4つの基がいずれも異なるものである場合、この炭素原子を不斉炭素原子といい、この存在が鏡像異性体の目印になる。なお、ここでの基は隣り合っているもののみならず、そこからつながる全体のことを指す。こうしてこの炭素原子周りの構造を考えていくと、この図のように立体的に見て回転させても完全に重なることのない二つの構造が浮かび上がる。これは鏡で互いに写しとった形をしているので、ここから鏡像異性体という名前がついている(のだと思う)。実際に頭の中で組み立ててみるなどして立体的に考えてみてほしい。一応軽くこれで考えてみよう。
続いては鏡像異性体。こちらも先に不斉炭素原子というものを紹介しておく。化合物の分子内のある炭素原子に対して、その価標に伸びている4つの基がいずれも異なるものである場合、この炭素原子を不斉炭素原子といい、この存在が鏡像異性体の目印になる。なお、ここでの基は隣り合っているもののみならず、そこからつながる全体のことを指す。こうしてこの炭素原子周りの構造を考えていくと、この図のように立体的に見て回転させても完全に重なることのない二つの構造が浮かび上がる。これは鏡で互いに写しとった形をしているので、ここから鏡像異性体という名前がついている(のだと思う)。実際に頭の中で組み立ててみるなどして立体的に考えてみてほしい。一応軽くこれで考えてみよう。
例題:示性式\(C_4 H_9 OH\)で表されるアルコールで、鏡像異性体が存在するものを、不斉炭素原子に*をつけて構造式を描け。
ここまでが異性体についての説明だ。これに関して問題文中の条件をもとに組み立てていくのが目的となってくる。
特有の構造に対する反応
ここからは特有の反応について少し触れていこう。ここで紹介するのは銀鏡反応、フェーリング液還元反応、ヨードホルム反応の3つである。
銀鏡反応、フェーリング液の還元
まずはこの二つから。というのもこの二つの反応はやっていることは基本的に一緒であるからだ。もちろん反応機構については違うので個別に説明していくが。
この二つの反応で調べることができるのはその化合物の還元性についてである。還元性を持つ物質をこれらの反応のもとに置くと、特有の変化を見せるので識別ができるというわけだ。基本的に有機化合物の範疇でいくとここで特異な変化が見られるのはアルデヒド系列と環状構造に含まれるヘミアセタール構造を持つ物質のいずれかである(後者については高分子の範囲なのでここでは省略して良い)ので、この反応が出てきたらこれを疑ってみると良い。アルデヒドが還元作用を持つことについては前回のページで述べたとおりである。続いてはこの反応機構について見ていこう。
まずは銀鏡反応の方から。アンモニア性硝酸銀水溶液に還元性を持つ物質を加えて温めると銀イオンが還元されて銀が析出するという反応である。ここではアルデヒドが銀イオンを還元してこの反応が起こっていると考えて良い。銀鏡反応についてはこちらの動画を参考にしていただければ良いかと。銀が析出してくる様子がよくわかるかと。動画の中ではグルコースを用いているが、これは先のヘミアセタール構造をグルコースが持っているからであり、やっていることはほぼ一緒である。
また、フェーリング液の還元について。まずフェーリング液とは、硫酸銅(Ⅱ)水溶液と酒石酸カリウムナトリウムのNaOH水溶液を使用直前に混合したものであり、これにアルデヒドなどを反応させると青色だったフェーリング液が赤色に変化する。これは液内の銅(Ⅱ)イオンが還元されて銅(Ⅰ)イオンになって沈殿するからだ。
以下にアルデヒドとそれぞれの反応との関連性についての反応式を示しておく。酸化還元の式がベースであるが、酸化数については最後に述べておくことにする。

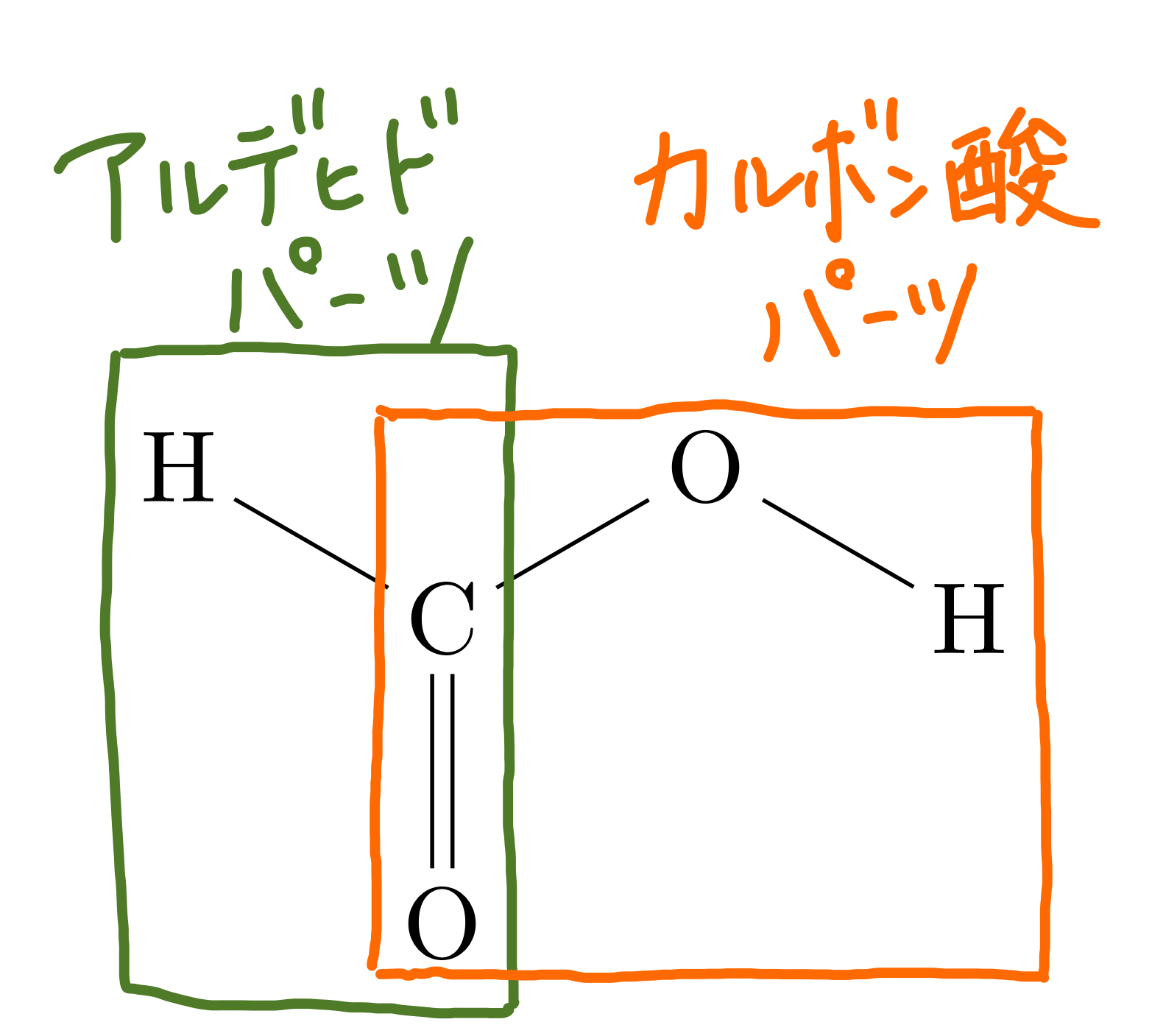 また、最後にここでギ酸という物質について説明しておこう。この物質は示性式HCOOHで表され、アルデヒドとカルボン酸の両方の性質を持つ物質である。これに関しては例外的にカルボン酸にもかかわらず還元性を持っていることから考える上では注意が必要だ。なお、右に構造式を示しておくので参考にして見てほしい。
また、最後にここでギ酸という物質について説明しておこう。この物質は示性式HCOOHで表され、アルデヒドとカルボン酸の両方の性質を持つ物質である。これに関しては例外的にカルボン酸にもかかわらず還元性を持っていることから考える上では注意が必要だ。なお、右に構造式を示しておくので参考にして見てほしい。
ヨードホルム反応
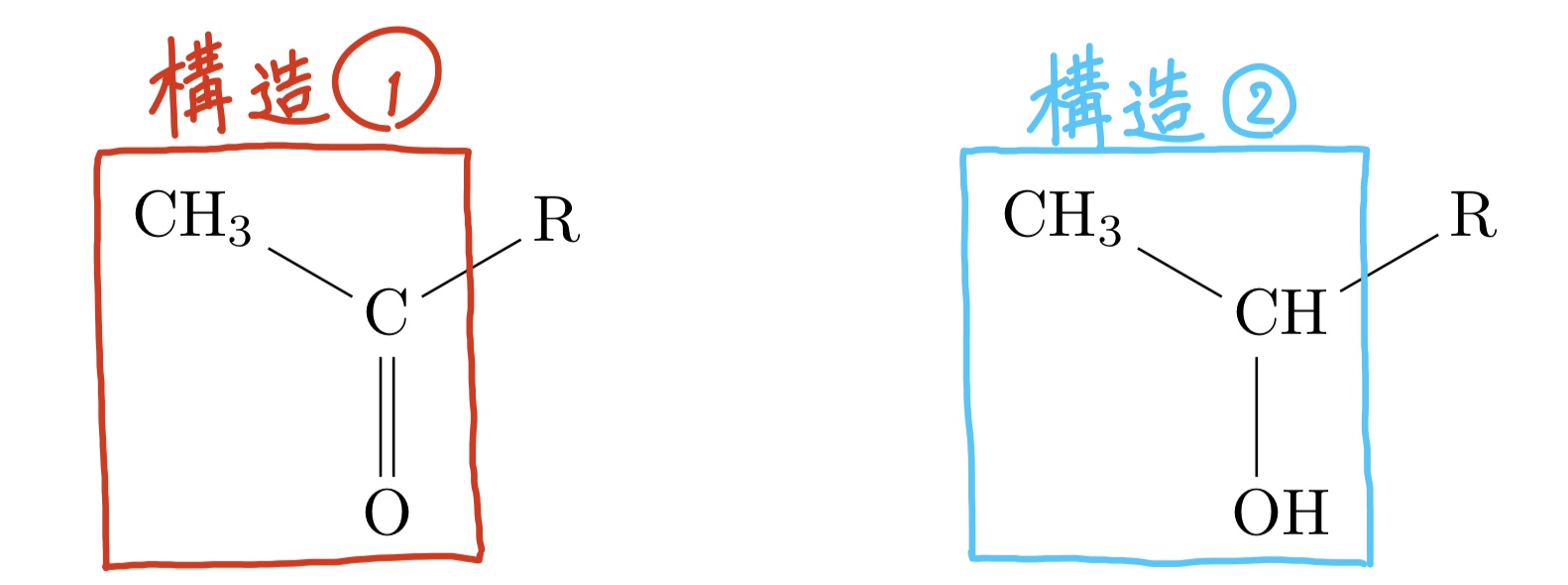 最後にもうひとつ、ヨードホルム反応について紹介しよう。これは多少複雑な構造の有無を判定する時に用いられ、右の図のような構造である。というのも、このヨードホルム反応を起こすためにはこの構造が欠かせないからである。下の反応式で示しているが、ここの構造に含まれているパーツによって特異臭をもつ黄色い物質、ヨードホルムCHI\(_3\)が生じるのである。反応の手順を合わせて説明しておくと、対象の化合物の水溶液にヨウ素と水酸化ナトリウム水溶液を混合して温めるといった感じだ。この操作に関しては問題文中にダイレクトに「ヨードホルム反応」と書かれないことも多いので、特にしっかりと覚えておく必要はあるであろう。
最後にもうひとつ、ヨードホルム反応について紹介しよう。これは多少複雑な構造の有無を判定する時に用いられ、右の図のような構造である。というのも、このヨードホルム反応を起こすためにはこの構造が欠かせないからである。下の反応式で示しているが、ここの構造に含まれているパーツによって特異臭をもつ黄色い物質、ヨードホルムCHI\(_3\)が生じるのである。反応の手順を合わせて説明しておくと、対象の化合物の水溶液にヨウ素と水酸化ナトリウム水溶液を混合して温めるといった感じだ。この操作に関しては問題文中にダイレクトに「ヨードホルム反応」と書かれないことも多いので、特にしっかりと覚えておく必要はあるであろう。 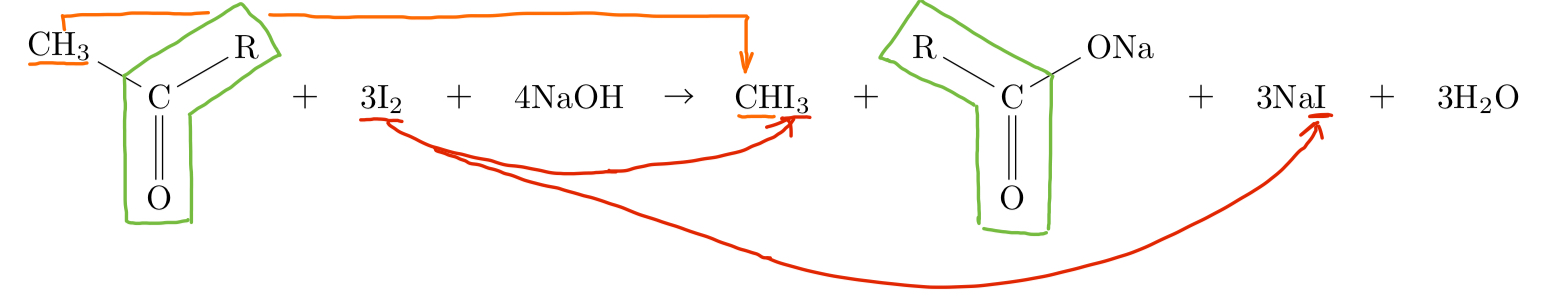
以上が特有の構造を確かめるための反応一覧である。ここまでの反応は入試問題でも頻出であることから、よく覚えておこう。なお、反応式や機構についてはおいおい覚えておけば良いと思う。とはいえ、大学によってはこの反応式を問うてくる大学も存在するので注意が必要である。
コメント